Lo sviluppo di un vaccino è un processo molto complesso che solitamente richiede circa 10 anni.
Alcuni vaccini contro la covid-19, dopo meno di un anno dall’esordio della malattia - da quel che ci è dato sapere il 31 dicembre 2019 è stato segnalato un focolaio di casi di polmonite di eziologia sconosciuta a Wuhan, nella provincia di Hubei, in Cina - sono già somministrati in una prima fase a medici, infermieri, personale e ospiti delle residenze sanitarie per anziani.
Quali condizioni hanno favorito l’accelerazione del processo di sviluppo e di autorizzazione all’utilizzo nell’Unione Europea?
Scopo di questo lavoro è quello di mettere in luce le principali argomentazioni che hanno accompagnato in ambito regolatorio e di controllo il percorso di rilascio dei vaccini attualmente disponibili sul nostro territorio: questo al fine di poter disporre di un quadro informativo completo, mettendo in evidenza anche importanti criticità che sono normalmente sottaciute.
Lo faremo attraversando le tappe fondamentali di un percorso a dir poco “accelerato”: dagli accordi di acquisto preliminare delle dosi di vaccino previste dai vari governi alle autorizzazioni al commercio, dalla valutazione dei rischi ai relativi piani di gestione. Riteniamo fondamentale che queste informazioni siano rese disponibili a tutti, in modo tale che la scelta di vaccinarsi o meno sia, come sempre dovrebbe essere, informata e consapevole.
Un’enorme accelerazione
Accordi Di Acquisto Preliminare
Al fine di sostenere l’industria nello sviluppo e nella produzione dei vaccini l’UE ha stipulato (e sta stipulando) accordi di acquisto preliminare (Advance Purchase Agreements, APAs) con le aziende farmaceutiche per milioni di dosi di vaccini che potrebbero o meno avere successo, coprendo così eventuali perdite.
Grazie a questi accordi, le aziende hanno anche potuto avviare la preparazione della produzione su scala industriale, ai fini della distribuzione commerciale, parallelamente alla realizzazione degli studi clinici.
A oggi sono stati conclusi contratti con AstraZeneca (400 milioni di dosi), Sanofi-GSK (300 milioni di dosi), Johnson e Johnson (dosi per 400 milioni di persone), BioNTech-Pfizer (300 milioni di dosi), CureVac (405 milioni di dosi) e Moderna (160 milioni di dosi).
Queste dosi saranno distribuite agli Stati membri in proporzione alla numerosità̀ delle rispettive popolazioni.
Nella Comunicazione della Commissione “COM(2020) 245 final1” del 17.6.2020 si legge:
“Il quadro proposto è pertanto una polizza assicurativa che trasferisce parte del rischio dall'industria alle autorità pubbliche in cambio della garanzia per gli Stati membri di un accesso equo e a un prezzo abbordabile al vaccino, una volta disponibile.”
Scrive Corporate Europe Observatory2:
“Questi lucrosi accordi vengono negoziati al buio e utilizzano il denaro pubblico per eliminare il rischio finanziario e - cosa molto preoccupante - la responsabilità delle aziende farmaceutiche che cercano di sviluppare i vaccini COVID-19, senza corrispondenti condizioni di interesse pubblico, per esempio legate ai prezzi e alla disponibilità”.
Si constata pertanto una totale mancanza di trasparenza di questi negoziati e dei relativi contratti (prezzo, proprietà intellettuale, responsabilità e altre condizioni), eppure l'interesse pubblico dovrebbe prevalere sulla "riservatezza commerciale" durante una pandemia.
Il Financial Times3 è venuto a conoscenza di un promemoria diffuso ai membri da Vaccines Europe, una divisione della Federazione Europea delle Industrie e delle Associazioni Farmaceutiche (European Federation of Pharmaceutical Industries and Associations, EFPIA) e ne riporta uno stralcio:
"La velocità e la portata dello sviluppo e del lancio impediscono di produrre la stessa quantità di evidenze fondamentali che normalmente sarebbero disponibili attraverso studi clinici estesi nel tempo e attraverso l’esperienza degli operatori sanitari".
Nel documento si afferma che ciò crea rischi “inevitabili” e che va sostenuto un "sistema di indennizzo totalmente privo di responsabilità e di contraddittorio oltre all'esenzione da responsabilità civile”.
Secondo il promemoria di Vaccines Europe, è probabile che alcune persone manifestino "eventi avversi" dopo la vaccinazione.
"Anche se tali eventi possono in realtà non essere correlati ai vaccini, fatti di questo tipo uniti a un alto livello di attenzione pubblica rivolta al Covid potrebbero portare a numerose richieste di risarcimento danni".
A conferma di tutto ciò, sulla “Scheda Informativa per gli operatori sanitari che somministrano il vaccino” Pfizer- BioNTech4 - negli USA la Food and Drug Administration (FDA) statunitense ha rilasciato un’Emergency Use Authorization (EUA) per consentire l'uso d'emergenza del prodotto non approvato - è riportato un avviso fondamentale:
“Sono state segnalate gravi reazioni allergiche a seguito del vaccino Pfizer-BioNTech COVID-19 durante la vaccinazione di massa al di fuori degli studi clinici. Ulteriori reazioni avverse, alcune delle quali possono essere gravi, possono diventare evidenti con un uso più diffuso del vaccino Pfizer-BioNTech COVID-19 Vaccine.”
Durante il meeting del 19 e 20 dicembre 2020 di ACIP5 (The Advisory Committee on Immunization Practices) il Dott. Clark ha presentato6 un aggiornamento sui vaccini COVID-19 e sull’anafilassi; oltre a segnalare a quella data il verificarsi di 8 casi di anafilassi a seguito della somministrazione del vaccino Pfizer-BioNTech, 2 nel Regno Unito e 6 negli USA, ha riportato i dati di V-safe Active Surveillance for COVID-19 Vaccines7 (uno strumento di sorveglianza attiva sviluppato attraverso un’app per smartphone) raccolti dal 14 al 18 dicembre.
Su 215.362 persone vaccinate che utilizzano V-safe, in 5 giorni, sono stati segnalati 5.052 eventi (in media 2.35%) di impatto sulla salute (incapace di svolgere le normali attività quotidiane, incapace di lavorare, necessita di assistenza medica o sanitaria).
Autorizzazione all'immissione in commercio condizionata (CMA)
Sempre al fine di accelerare l'autorizzazione e la disponibilità di vaccini contro la COVID-19, le autorità europee garantiscono massima flessibilità nel processo normativo attraverso la procedura di autorizzazione all'immissione in commercio condizionata (CMA, Conditional Marketing Approval), concepita per consentire l'autorizzazione all'immissione in commercio il più rapidamente possibile, non appena disponibili dati sufficienti presentati dallo sviluppatore del vaccino nel corso delle "revisioni a rotazione8”. Il richiedente potrà presentare dati aggiuntivi anche dopo l'autorizzazione all'immissione in commercio, contrariamente ad una normale autorizzazione all'immissione in commercio in cui tutti i dati sono presentati prima del rilascio dell'autorizzazione.
Una volta ottenuta l’autorizzazione, il vaccino può essere commercializzato ovunque nell’UE.
Il CMA (Conditional Marketing Approval) è valido per un anno, su base rinnovabile.
L’Autorizzazione è subordinata alla presentazione, entro un periodo di tempo definito e a determinate scadenze, di ulteriori dati a supporto e consolidamento delle evidenze di efficacia e sicurezza (Specific Obligations - SOs), derivanti sia da studi ancora in corso al momento dell’autorizzazione per acquisire i risultati finali anche su nuovi endpoint, sia dando avvio a nuovi studi.
La licenza può essere convertita in standard marketing authorization successivamente alla presentazione dei dati richiesti.
Per i vaccini anti-covid le autorizzazioni condizionate saranno in futuro convertite in standard marketing authorization?
Si legge nel Rapporto pubblico di valutazione (EPAR public Assessment report) del vaccino Comirnaty di Pfizer-BioNTech9
“È probabile che il richiedente sarà in grado di fornire dati completi.
Il Richiedente intende continuare lo studio di Fase 3 in corso con i partecipanti come originariamente assegnato il più a lungo possibile, per ottenere dati a lungo termine e per garantire un seguito sufficiente a sostegno di un'autorizzazione all'immissione in commercio standard. In caso di disponibilità di un qualsiasi vaccino COVID-19, lo sponsor farà appello ai partecipanti affinché rimangano nello studio in corso come originariamente randomizzato il più a lungo possibile, idealmente fino a quando un vaccino COVID-19 avrà la piena approvazione regolamentare. In tutti i casi, si intende seguire i partecipanti fino ai 24 mesi previsti originariamente dopo la vaccinazione, indipendentemente dal fatto che i partecipanti scelgano di passare dal placebo alla vaccinazione attiva.”
È chiaro che la possibile fuoriuscita dei partecipanti dallo studio cardine, quello su cui si è basata l’autorizzazione all’immissione in commercio condizionata, potrebbe inficiare la possibilità di completare/integrare gli studi e di confermare i benefici del vaccino; infatti, “L’obiettivo dello studio è quello di valutare la sicurezza, la tollerabilità, l'immunogenicità e l'efficacia del vaccino m-RNA COVID-19.”
L’eventuale conferma, in ogni caso, potrebbe arrivare tra due anni… Il titolare della licenza, infatti, dovrà presentare la relazione finale dello studio cardine, soggetta a Obbligo Specifico nel contesto di un'autorizzazione all'immissione in commercio condizionata, entro dicembre 2023.
Gli USA, invece, hanno optato per un'autorizzazione all'uso d'emergenza (EUA)10 che consente l'uso temporaneo del vaccino, che rimane tuttavia privo di licenza, ossia non approvato e non immesso in commercio, contrariamente a quanto previsto da un'autorizzazione all'immissione in commercio (condizionata).
"In una situazione di autorizzazione d’emergenza (EUA) per l’utilizzo di un vaccino, per quanto sia possibile date le circostanze, la FDA deve garantire che i destinatari di tale vaccino (autorizzato per l’uso in emergenza) siano accuratamente informati del fatto che il farmaco è soggetto a questo tipo di autorizzazione, dei benefici e dei rischi noti e potenziali, della misura in cui tali benefici e rischi sono sconosciuti, del fatto che sia possibile accettare o rifiutare il vaccino, e di qualsiasi alternativa disponibile al prodotto.”
OGM: valutazione preventiva dei rischi per la salute umana e per l’ambiente
Va rilevato, innanzitutto, che la maggior parte dei vaccini fra i quali Pfizer-BioNTech, Moderna e Astrazeneca, sono definiti farmaci OGM; la tecnologia mRNA applicata a vaccini preventivi, quali quello di Pfizer-BioNTech e Moderna, oltretutto, non era mai stata oggetto di licenza da parte delle Autorità regolatorie e, pertanto, si tratta di farmaci preventivi che utilizzano una sostanza attiva che NON è mai stata ancora testata in condizioni reali e su vasta scala.
A conferma di ciò nel rapporto pubblico di valutazione (European Public Assessment Report, EPAR) del vaccino Pfizer-BioNTech si legge11 :
“Il CHMP ritiene che l'RNA messaggero (mRNA) a filamento singolo, 5'-capped messenger RNA (mRNA) prodotto utilizzando una trascrizione in vitro priva di cellule dai corrispondenti modelli di DNA, che codifica la proteina del picco virale (S) della SARS-CoV-2 è una nuova sostanza attiva in quanto non è un componente di un medicinale precedentemente autorizzato all'interno dell'Unione Europea.”
Seppur molti esperti mettono in guardia sulla possibilità teorica che si possa verificare una retrotrascrizione da mRNA a DNA, ovvero segnalano l’eventualità che il nostro genoma possa subire una mutazione, e al di là di ogni eventuale e non trascurabile impatto sulla salute e sull’ambientale, lo scorso luglio, su proposta della Commissione europea approvata dal Parlamento, il Consiglio Europeo ha emanato un Regolamento12 che deroga “per il periodo durante il quale la pandemia di Covid-19 è considerata un'emergenza sanitaria pubblica, da alcune disposizioni della direttiva OGM per le sperimentazioni cliniche con vaccini contro la Covid-19 (e anche per i trattamenti contro la Covid-19) contenenti OGM o da essi costituiti. La deroga proposta si applicherà alle operazioni necessarie nella fase di sperimentazione clinica e nell'uso compassionevole o di emergenza nel contesto della pandemia di Covid-19.”
È possibile affermare, pertanto, che oggi non sappiamo se questa nuova sostanza attiva OGM possa causare effetti potenzialmente negativi sulla salute umana e sull’ambiente.
Piano per la gestione del rischio (RMP)
Una caratteristica esecutiva dell’autorizzazione alla immissione in commercio condizionata (Conditional Marketing Approval, CMA) è l’implementazione di un piano per la gestione del rischio (RMP) da parte dello sviluppatore del vaccino concordato con l’autorità regolatoria prima della autorizzazione.
La Commissione Europea ha concesso un'autorizzazione all'immissione in commercio condizionata (CMA) a Pfizer e BioNTech per Comirnaty (noto anche come BNT162b2) lo scorso 22 dicembre. È utile elencare, pertanto, quali sono i rischi importanti - noti e potenziali - e le informazioni mancanti per questo vaccino a m-RNA dettagliati nel piano per la gestione del rischio (RMP)13 nell’ambito dell'European Public Assessment Report (EPAR)14.
L’argomento merita una trattazione ampia e approfondita e sarà presto oggetto di una pubblicazione dedicata; lo scopo ora è indirizzato a fornire un quadro generale delle criticità.
Elenco dei rischi importanti e delle informazioni mancanti
“I rischi importanti di Comirnaty sono rischi che richiedono particolari attività di gestione del rischio per indagare ulteriormente o ridurre al minimo il rischio, in modo che il medicinale possa essere somministrato in sicurezza.
I rischi importanti possono essere considerati come identificati o potenziali.
I rischi identificati sono preoccupazioni per le quali esiste una prova sufficiente di un legame con l'uso di Comirnaty.
I rischi potenziali sono preoccupazioni per le quali è possibile un'associazione con l'uso di questo medicinale sulla base dei dati disponibili, ma tale associazione non è stata ancora stabilita e necessita di un'ulteriore valutazione.
Le informazioni mancanti si riferiscono alle informazioni sulla sicurezza del medicinale attualmente mancanti e che devono essere raccolte (ad es. sull'uso a lungo termine del medicinale).”
Riassumiamo di seguito quanto andremo a declinare nel dettaglio di seguito:
- I rischi identificati:
- Anafilassi
- Anafilassi
- Importanti rischi potenziali:
- Vaccine-Associated Enhanced Disease (VAED), inclusa la Vaccine-Associated Enhanced Respiratory Disease (VAERD)”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP)
- Vaccine-Associated Enhanced Disease (VAED), inclusa la Vaccine-Associated Enhanced Respiratory Disease (VAERD)”
- Informazioni mancanti:
- “Uso in gravidanza e durante l’allattamento”
-
“Uso in pazienti immunocompromessi”
-
“Uso in pazienti fragili con comorbilità̀ (ad esempio, broncopneumopatia cronica ostruttiva (BPCO), diabete, malattie neurologiche croniche, disturbi cardiovascolari)”
NB: Questa indicazione è riportata in maniera parziale (riferita all’efficacia e non alla sicurezza) nel Riassunto delle Caratteristiche di prodotto (RCP) -
“Uso in pazienti con disturbi autoimmuni o infiammatori”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP) -
“Interazione con altri vaccini”
-
“Dati sulla sicurezza a lungo termine”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP)
Importanti rischi identificati:
“Anafilassi”
Si tratta di un evento potenzialmente mortale che richiede un tempestivo intervento medico.
Nel Riassunto delle Caratteristiche di Prodotto15 (RCP) troviamo le seguenti indicazioni:
4.3 Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
4.4 Avvertenze speciali e precauzioni d’impiego
Ipersensibilità e anafilassi
Sono stati segnalati casi di anafilassi. Devono essere sempre immediatamente disponibili trattamento e assistenza medica adeguati nel caso di comparsa di una reazione anafilattica in seguito alla somministrazione del vaccino.
Dopo la vaccinazione si raccomanda un attento monitoraggio per almeno 15 minuti. Non somministrare la seconda dose del vaccino a soggetti che abbiano manifestato anafilassi alla prima dose di Comirnaty.
Mentre nel Regno Unito nel “Package leaflet” viene indicato di confrontarsi con il proprio medico, farmacista o personale infermieristico nel caso in cui si avesse avuto in precedenza una grave reazione allergica a un vaccino, a un medicinale o anche a un alimento.
Sono esaustive le indicazioni riportate nel Riassunto delle Caratteristiche di Prodotto (RCP) per ridurre al minimo il rischio di incorrere in un simile evento?
Secondo uno studio promosso dai Centers for Disease Control and Prevention degli Stati Uniti e pubblicato nel 201516, la vaccinazione scatena molto raramente l’anafilassi: il tasso di anafilassi è risultato pari a 1.31 casi per milione di dosi, ovvero il ricercatori hanno identificato 33 casi confermati di anafilassi innescata dal vaccino che si sono verificati a seguito della somministrazione di 25.173.965 dosi di vaccino analizzando tutti i dati riferiti a tre anni (da gennaio 2009 a dicembre 2011).
Al 18 dicembre, stando ai report dei Centers for Disease Control and Prevention (CDC), negli Stati Uniti sono stati documentati almeno sei casi di anafilassi tra le 272.001 persone che hanno ricevuto il vaccino Pfizer-BioNTech, mentre a quella data nel Regno Unito se ne contavano due17.
Il rischio, pertanto, appare ben oltre la soglia osservata per altri vaccini.
In un recente articolo la rivista Science18 rileva che Pfizer nei trial clinici avrebbe escluso partecipanti con storia di allergia ai componenti del vaccino e soggetti che avevano avuto una reazione grave ad altri vaccini.
Alcuni esperti sospettano che le nanoparticelle lipidiche (LNP) che permettono al materiale genetico di penetrare all’interno delle cellule, essendo PEGilate – ovvero legate a un composto, il polietilenglicole (PEG) – possano indurre reazioni anafilattiche in individui con anticorpi PEG preesistenti. Le risposte immunitarie specifiche verso questa sostanza, inoltre, potrebbero ridurre l'efficacia dei vaccini.
Nell'European Public Assessment Report (EPAR) si evidenzia che nel prodotto finito sono inclusi due nuovi (mai utilizzati in vaccini iniettabili) eccipienti: il lipide cationico ALC-0315 e il lipide PEGilato ALC-0159 dei quali sono fornite informazioni limitate, ma allo sviluppatore non sono richiesti studi mirati riguardo alla sicurezza.
Si legge nel Rapporto pubblico di valutazione (EPAR Public Assessment Report):
“Questa preoccupazione per la sicurezza sarà seguita attraverso le attività di farmacovigilanza di routine e negli studi di sicurezza pianificati e in corso e sarà riportata nei rapporti mensili di sintesi sulla sicurezza e nei PSUR19 (Periodic Safety Update Reports).”
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per rischio di anafilassi codificate come segue:
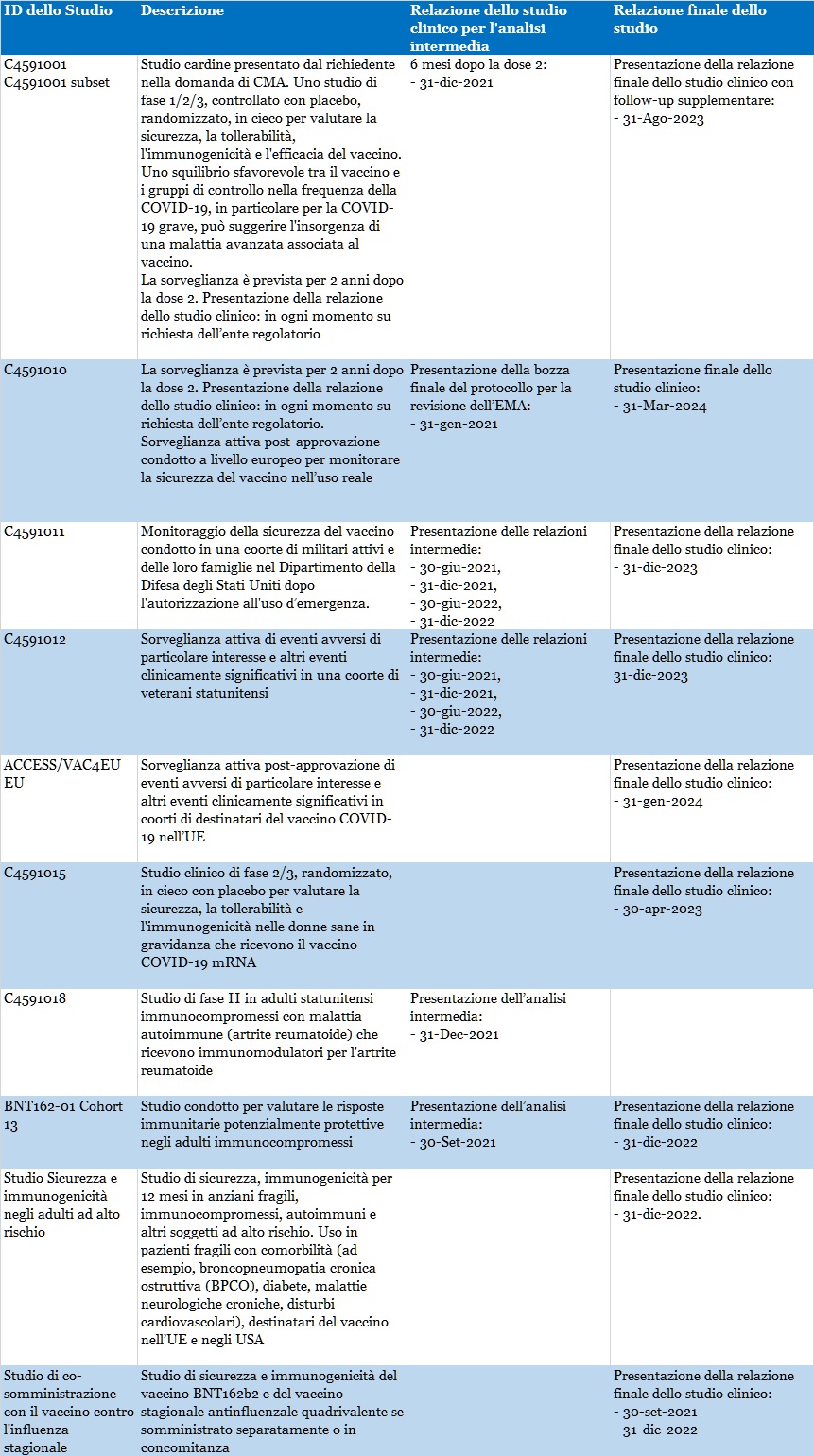
- Studio N. C4591001: Uno studio di fase 1/2/3, controllato con placebo, randomizzato, in cieco per valutare la sicurezza, la tollerabilità, l'immunogenicità e l'efficacia del vaccino;
- Studio N. C4591010: sorveglianza attiva post-approvazione condotto a livello europeo per monitorare la sicurezza del vaccino nell’uso reale;
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE
Per una descrizione più completa di queste attività di farmacovigilanza rimandiamo alla Tabella 1, nella quale sono evidenziate anche le tempistiche associate: questa informazione è fondamentale per comprendere con estrema chiarezza come l’attuale campagna di vaccinazione sia di fatto una vera e propria sperimentazione su larghissima scala
Importanti rischi potenziali:
Vaccine-Associated Enhanced Disease (VAED), inclusa la
Vaccine-Associated Enhanced Respiratory Disease (VAERD)”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP)
Le malattie potenziate associate al vaccino (VAED) si verificano quando manifestazioni di infezioni cliniche modificate e/o più gravi colpiscono gli individui, precedentemente vaccinati, esposti all’infezione naturale (agente patogeno di tipo selvaggio) per lo stesso agente patogeno.
Riporta il Piano per la gestione del rischio (RMP):
“Ciò può comportare che gli individui che si presume siano a minor rischio di sviluppare una forma grave di COVID-19 sviluppino una malattia più grave, che per gli individui a rischio grave noto per la COVID-19 (ad esempio, i più anziani o gli immunocompromessi) si riscontrino tassi più elevati di esiti fatali, o che si osservi uno squilibrio sfavorevole di gravi casi di COVID-19 in individui vaccinati rispetto a quelli non vaccinati. È difficile, se non impossibile, valutare la VAED/VAERD su base individuale, data la mancanza attuale di specifici marcatori clinici o di laboratorio, pertanto occorre effettuare una sorveglianza a livello di popolazione, come notato sopra.”
Non esiste una definizione uniformemente accettata di VAED o VAERD. I termini correlati utilizzati di frequente includono "malattia potenziata mediata dal vaccino (VMED)", "malattia respiratoria potenziata (ERD)", "potenziamento dell'infezione indotta dal vaccino", "potenziamento della malattia", "potenziamento delle difese immunitarie" e "potenziamento degli anticorpi dipendenti (ADE)".
Tutto ciò potrebbe rendere problematica la comparabilità dei dati tra gli studi o dei dati raccolti attraverso i sistemi di sorveglianza se non viene utilizzata una definizione coerente dei casi 20.
Si legge nel Piano per la gestione del rischio (RMP):
“Un vaccino efficace contro il COVID-19 che produce alti titoli neutralizzanti e una risposta cellulare CD4+ T predominante nel TH1 e una forte risposta cellulare CD8+ T, ci si aspetta che attenui il rischio di VAED/VAERD; questo profilo immunitario è suscitato da BNT162b2 in studi clinici e preclinici.”
Si ipotizza che il rischio di incorrere in un tal fenomeno sia più alto negli individui che producono titoli anticorpali neutralizzanti inferiori o in quelli che dimostrano di perdere l'immunità.
Ma come è noto il campionamento degli studi clinici, incluso lo studio di fase III composto da circa 44.000 individui di cui grossomodo la metà ha ricevuto il placebo, non è pienamente rappresentativo. Nel “Riassunto del profilo di sicurezza” del RCP, inoltre, è indicato che “La sicurezza di Comirnaty è stata valutata in soggetti di età pari o superiore a 16 anni nel corso di 2 studi clinici che hanno coinvolto 21.744 partecipanti i quali hanno ricevuto almeno una dose di Comirnaty. (…) Al momento dell’analisi dello Studio 2, la sicurezza è stata valutata in un totale di 19.067 partecipanti (9.531 trattati con Comirnaty e 9.536 trattati con placebo) di età pari o superiore a 16 anni, per almeno 2 mesi dopo la seconda dose di Comirnaty.”
Nel Piano per la gestione del rischio (RMP), attualmente, è proposto di monitorare l’impatto sul rapporto rischio/beneficio del farmaco osservando i casi COVID-19 nei partecipanti che ricevono il vaccino contro quelli che ricevono il placebo, fornendo una rassicurazione contro il rischio potenziale di VAED/VAERD. Se ci fosse un equilibrio sfavorevole nei casi di COVID-19, compresi i casi gravi, tra il gruppo del vaccino e quello del placebo, questo potrebbe segnalare VAED/VAERD.
Al di là delle problematiche riscontrabili relative alla rappresentatività e all’ampiezza del campionamento, non vi è alcuna garanzia sulla permanenza dei partecipanti fino alla conclusione dello studio, come già precedentemente accennato.
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per l’importante rischio potenziale di VAED, incluso il VAERD:
- Studio N. C4591001: Uno studio di fase 1/2/3, controllato con placebo, randomizzato, in cieco per valutare la sicurezza, la tollerabilità, l'immunogenicità e l'efficacia del vaccino;
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE
Ancora, per una descrizione più completa di queste attività di farmacovigilanza rimandiamo alla Tabella 1.
La valutazione di questo potenziale evento avverso è fondamentale considerato l’obiettivo di raggiungere un’altissima copertura vaccinale, paventando persino strumenti gravemente limitativi delle libertà individuali: esporre la popolazione a sviluppare forme più gravi e anche letali della malattia avrebbe un impatto clinico e sociale davvero drammatico.
Informazioni mancanti:
“Uso in gravidanza e durante l’allattamento”
Nel Riassunto delle Caratteristiche di Prodotto21 (RCP) troviamo le seguenti indicazioni:
4.6 Fertilità, gravidanza e allattamento
Gravidanza
I dati relativi all’uso di Comirnaty in donne in gravidanza sono in numero limitato. Gli studi sugli animali non indicano effetti dannosi diretti o indiretti su gravidanza, sviluppo embrionale/fetale, parto o sviluppo post-natale (vedere paragrafo 5.3). La somministrazione di Comirnaty durante la gravidanza deve essere presa in considerazione solo se i potenziali benefici sono superiori ai potenziali rischi per la madre e per il feto.
Allattamento
Non è noto se Comirnaty sia escreto nel latte materno.
Nel Piano per la gestione del rischio (RMP) si legge:
“Il profilo di sicurezza del vaccino non è noto nelle donne in gravidanza o in allattamento a causa della loro esclusione dallo studio clinico cardine. Ci possono essere donne in gravidanza che scelgono di essere vaccinate nonostante la mancanza di dati sulla sicurezza. Sarà importante seguirle per gli esiti della gravidanza e del parto. I tempi della vaccinazione in una donna in gravidanza e la conseguente risposta immunitaria possono avere impatti variabili favorevoli o sfavorevoli sull’embrione/feto.”
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “uso in gravidanza e durante l’allattamento”:
- Studio N. C4591010: sorveglianza attiva post-approvazione condotto a livello europeo per monitorare la sicurezza del vaccino nell’uso reale;
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591015: uno studio clinico di fase 2/3, randomizzato, in cieco con placebo per valutare la sicurezza, la tollerabilità e l'immunogenicità nelle donne sane in gravidanza che ricevono il vaccino COVID-19 m-RNA;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE.
Per i dettagli si rimanda sempre alla Tabella 1.
Informazioni mancanti:
“Uso in pazienti immunocompromessi”
Nel Riassunto delle Caratteristiche di Prodotto (RCP)22 troviamo le seguenti indicazioni:
Soggetti immunocompromessi
L’efficacia, la sicurezza e l’immunogenicità del vaccino non sono state valutate nei soggetti immunocompromessi, compresi quelli in terapia immunosoppressiva. L’efficacia di Comirnaty potrebbe essere inferiore nei soggetti immunocompromessi.
Nel Piano per la gestione del rischio (RMP) si legge:
“Il profilo di sicurezza del vaccino non è noto negli individui immunocompromessi a causa della loro esclusione dallo studio clinico fondamentale. L'efficacia del vaccino può essere inferiore negli individui immunocompromessi, diminuendo così la loro protezione da COVID-19.”
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “uso in pazienti immunocompromessi”:
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. C4591018: Studio di fase II in adulti statunitensi immunocompromessi con malattia autoimmune (artrite reumatoide) che ricevono immunomodulatori per l'artrite reumatoide;
- Studio N. BNT162-01 Cohort 13: Per valutare le risposte immunitarie potenzialmente protettive negli adulti immunocompromessi;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE.
Per i dettagli si rimanda sempre alla Tabella 1.
Informazioni mancanti:
“Uso in pazienti fragili con comorbilità̀ (ad esempio, broncopneumopatia cronica ostruttiva (BPCO), diabete, malattie neurologiche croniche, disturbi cardiovascolari)”
NB: Questa indicazione è riportata in maniera parziale (riferita all’efficacia e non alla sicurezza) nel Riassunto delle Caratteristiche di prodotto (RCP)
Nel Riassunto delle Caratteristiche di Prodotto (RCP)23 troviamo le seguenti indicazioni:
5.1 Proprietà farmacodinamiche
Non sono state rilevate differenze cliniche significative in termini di efficacia complessiva del vaccino nei partecipanti a rischio di COVID-19 severa, compresi quelli con uno o più̀ comorbilità suscettibili di aumentare il rischio di COVID-19 severa (ad es. asma, indice di massa corporea (IMC) ≥30 kg/m2, malattia polmonare cronica, diabete mellito, ipertensione).
(…)
Inoltre, le analisi per sottogruppi dell’endpoint primario di efficacia hanno dimostrato stime puntuali di efficacia paragonabili fra sessi, gruppi razziali ed etnie, e fra partecipanti con comorbilità associate a un rischio elevato di COVID-19 severa.
Nel Piano per la gestione del rischio (RMP) si legge:
“Ci sono informazioni limitate sulla sicurezza del vaccino in pazienti fragili con comorbilità che sono potenzialmente a più alto rischio di COVID-19 grave.”
Eppure, secondo quanto riporta il Piano Strategico italiano24, sono considerati soggetti a elevata priorità per la vaccinazione:
- Residenti dei presidi residenziali per anziani;
- Persone di età avanzata,
che si suppone rappresenti in gran parte una popolazione fragile con comorbilità.
Il vaccino, si legge,
“è stato studiato in individui con malattie croniche stabili (ad esempio ipertensione, obesità), tuttavia non è stato studiato in individui fragili con gravi comorbilità che possono compromettere la funzione immunitaria”.
E nel seguito:
“I dati di sicurezza saranno raccolti in individui fragili a causa dell'età o di malattie debilitanti negli studi di sorveglianza attiva e attraverso la farmacovigilanza di routine.”
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “uso in pazienti fragili con comorbilità”:
- Studio N. C4591001 subset: Uno studio di fase 1/2/3, controllato con placebo, randomizzato, in cieco per valutare la sicurezza, la tollerabilità, l'immunogenicità e l'efficacia del vaccino;
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE;
- Studio Sicurezza e immunogenicità negli adulti ad alto rischio: sicurezza, immunogenicità per 12 mesi in anziani fragili, immunocompromessi, autoimmuni e altri soggetti ad alto rischio.
Per i dettagli si rimanda sempre alla Tabella 1.
Informazioni mancanti:
“Uso in pazienti con disturbi autoimmuni o infiammatori”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP)
Nel Piano per la gestione del rischio (RMP) si legge:
“Ci sono informazioni limitate sulla sicurezza del vaccino in individui con disturbi autoimmuni o infiammatori e una preoccupazione teorica che il vaccino possa esacerbare la loro malattia di base.”
E nel seguito:
“I dati sulla sicurezza saranno raccolti in individui con malattie autoimmuni o infiammatorie croniche, compresi quelli che potrebbero essere sotto immunosoppressori negli studi di sorveglianza attiva.”
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “uso in pazienti con disturbi autoimmuni o infiammatori”:
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. C4591018: Studio di fase II in adulti statunitensi immunocompromessi con malattia autoimmune (artrite reumatoide) che ricevono immunomodulatori per l'artrite reumatoide;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE.
Per i dettagli si rimanda sempre alla Tabella 1.
Informazioni mancanti:
“Interazione con altri vaccini”
Nel Riassunto delle Caratteristiche di Prodotto25 (RCP) troviamo le seguenti indicazioni:
4.5 Interazioni con altri medicinali ed altre forme d’interazione
Non sono stati effettuati studi d’interazione.
La somministrazione concomitante di Comirnaty con altri vaccini non è stata studiata.
Nel Piano per la gestione del rischio (RMP) si legge:
“Il vaccino m-RNA BNT162b2 sarà utilizzato in individui che possono ricevere anche altri vaccini. Non sono stati eseguiti studi per determinare se la co-somministrazione del vaccino m-RNA BNT162b2 con altri vaccini può influenzare l'efficacia o la sicurezza di uno dei due vaccini.”
Nel Rapporto pubblico di valutazione (EPAR public Assessment report) si riporta:
“Poiché gli individui anziani saranno un gruppo target per la vaccinazione, e spesso possono aver bisogno di vaccinazioni con altri vaccini come l'influenza e il pneumococco, sono richiesti ulteriori dati. Il richiedente si impegna a condurre uno studio sulla co-somministrazione di Comirnaty con il vaccino antinfluenzale quadrivalente inattivato.”
Ciò fa supporre che la vaccinazione anti-covid diventi routinaria.
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “interazione con altri vaccini”:
- Studio di co-somministrazione con il vaccino contro l'influenza stagionale: sicurezza e immunogenicità del vaccino BNT162b2 e del vaccino stagionale antinfluenzale quadrivalente se somministrato separatamente o in concomitanza.
Per i dettagli si rimanda sempre alla Tabella 1.
Informazioni mancanti:
“Dati sulla sicurezza a lungo termine”
NB: Questa indicazione NON è riportata nel Riassunto delle Caratteristiche di Prodotto (RCP)
Nel Piano per la gestione del rischio (RMP) si legge:
“La sicurezza a lungo termine del vaccino m-RNA BNT162b2 è attualmente sconosciuta, tuttavia ulteriori dati sulla sicurezza sono in corso di raccolta nello studio C4591001 per un massimo di 2 anni dopo la somministrazione della seconda dose del vaccino m-RNA BNT162b2.”
Sulle criticità dello studio cardine abbiamo già accennato sopra.
Nel Piano per la gestione del rischio (RMP) sono indicate le seguenti attività di farmacovigilanza aggiuntive per le informazioni mancanti “dati sulla sicurezza a lungo termine”:
- Studio N. C4591001: Uno studio di fase 1/2/3, controllato con placebo, randomizzato, in cieco per valutare la sicurezza, la tollerabilità, l'immunogenicità e l'efficacia del vaccino;
- Studio N. C4591010: sorveglianza attiva post-approvazione condotto a livello europeo per monitorare la sicurezza del vaccino nell’uso reale;
- Studio N. C4591011: monitoraggio della sicurezza del vaccino condotto in una coorte di militari attivi e delle loro famiglie nel Dipartimento della Difesa degli Stati Uniti dopo l'autorizzazione all'uso d’emergenza;
- Studio N. C4591012: sorveglianza attiva di eventi avversi di particolare interesse e altri eventi clinicamente significativi in una coorte di veterani statunitensi;
- Studio N. ACCESS/VAC4EU EU: sorveglianza attiva post-approvazione di eventi avversi di particolare interesse e altri eventi clinicamente significativi in coorti di destinatari del vaccino COVID-19 nell’UE
Per i dettagli si rimanda sempre alla Tabella 1.
All’elenco di informazioni mancanti va aggiunto che:
“Non sono stati condotti studi di farmacologia di sicurezza, genotossicità e cancerogenicità, in conformità con la linea guida dell'OMS per i vaccini del 2005”.
Come indicato nel Piano per la gestione del rischio (RMP).
EMA nel 2001 ha pubblicato una guida agli studi di farmacologia di sicurezza rilevando che:
“si applica generalmente alle nuove entità chimiche e ai prodotti derivati dalla biotecnologia per uso umano”.
Valutazioni conclusive
Dal quadro complessivo descritto sopra, emerge chiaramente che le preoccupazioni riguardo alle informazioni mancanti e agli importanti rischi identificati (noti e potenziali), nonché le conferme relative a tollerabilità, efficacia e sicurezza dei vaccini covid, potrebbero trovare risposta soprattutto nelle attività di vigilanza post-autorizzazione (attiva e passiva), ovvero durante l’uso reale del vaccino m-RNA COVID-19.
E in ogni caso, come si può constatare, la scadenza degli studi clinici sopra indicati non è certo antecedente alle agende vaccinali dei governi per la somministrazione di massa del vaccino anti-covid.
In Italia non è chiaro, oltretutto, se sia effettivamente operante un’anagrafe vaccinale nazionale.
Il NITAG26, infatti,, sei mesi fa, ha dichiarato che non è ancora funzionante l’anagrafe nazionale vaccini prevista nel 2017 dalla legge Lorenzin (che ha reso obbligatorie 10 vaccinazioni alla popolazione pediatrica, da zero a sedici anni) e istituita con Decreto del ministero della Salute 17 settembre 2018.
Il ministero della Salute, in base alla legge 119/2017, dopo tre anni dalla promulgazione, “sulla base della verifica dei dati epidemiologici, delle eventuali reazioni avverse e delle coperture vaccinali raggiunte” avrebbe potuto riconsiderare l’obbligatorietà di quattro vaccinazioni (morbillo, rosolia, parotite e varicella).
Questa verifica è stata affidata a un comitato con funzione consultiva, chiamato Nitag (National Immunization Technical Advisory Group).
Nella relazione del NITAG, pubblicata da Quotidiano Sanità, si legge:
“Il percorso di attuazione della legge appare ancora non completato”. E “non risulta ancora pienamente funzionante presso il Ministero della Salute l’anagrafe nazionale vaccini, prevista dalla legge, istituita proprio per consentire il monitoraggio sullo stato di attuazione dei programmi vaccinali”. Raccomanda, inoltre, “che venga accelerato il processo di implementazione dell’anagrafe nazionale vaccini, identificando e superando i fattori che ancora ostacolano il suo funzionamento”, e suggerisce “Un’urgente analisi dei fattori che possono aver ostacolato la sua realizzazione e il pieno funzionamento, al fine di rimuoverli tempestivamente e favorire così lo sblocco della fonte informativa fondamentale per monitorare l’andamento delle attività̀ di prevenzione vaccinale”.
Eppure Domenico Arcuri - il Commissario straordinario per l'attuazione e il coordinamento delle misure occorrenti per il contenimento e contrasto dell'emergenza epidemiologica COVID-19 - riguardo al tema della piattaforma digitale per i vaccini covid dichiara27: “Poste Italiane ed Eni ci stanno aiutando nell’implementazione di una app, è un sistema molto complesso nel quale ci saranno molte componenti: un call center, elementi di tracciabilità, riconoscibilità e possibilità di alimentare i sistemi informativi delle regioni e del ministero della salute nell’implementazione di una sorta di anagrafe dei vaccini uguale a quella che c’è per tutti i vaccini somministrati per la popolazione italiana”.
Come si evince dalla sintesi del “Piano vaccini covid”28 presentata in Conferenza Stato Regioni lo scorso 7 dicembre (vedi slide sotto), il sistema informativo, che sarebbe già in corso di realizzazione, prevede la gestione della distribuzione del vaccino (spedizione, distribuzione, logistica) con tracciabilità in tempo reale, la prenotazione, l’accettazione e l’erogazione, la farmaco vigilanza e il follow up.
Tutti i dati confluiranno nel sistema informativo che sarà in grado di elaborare informazioni in tempo reale.
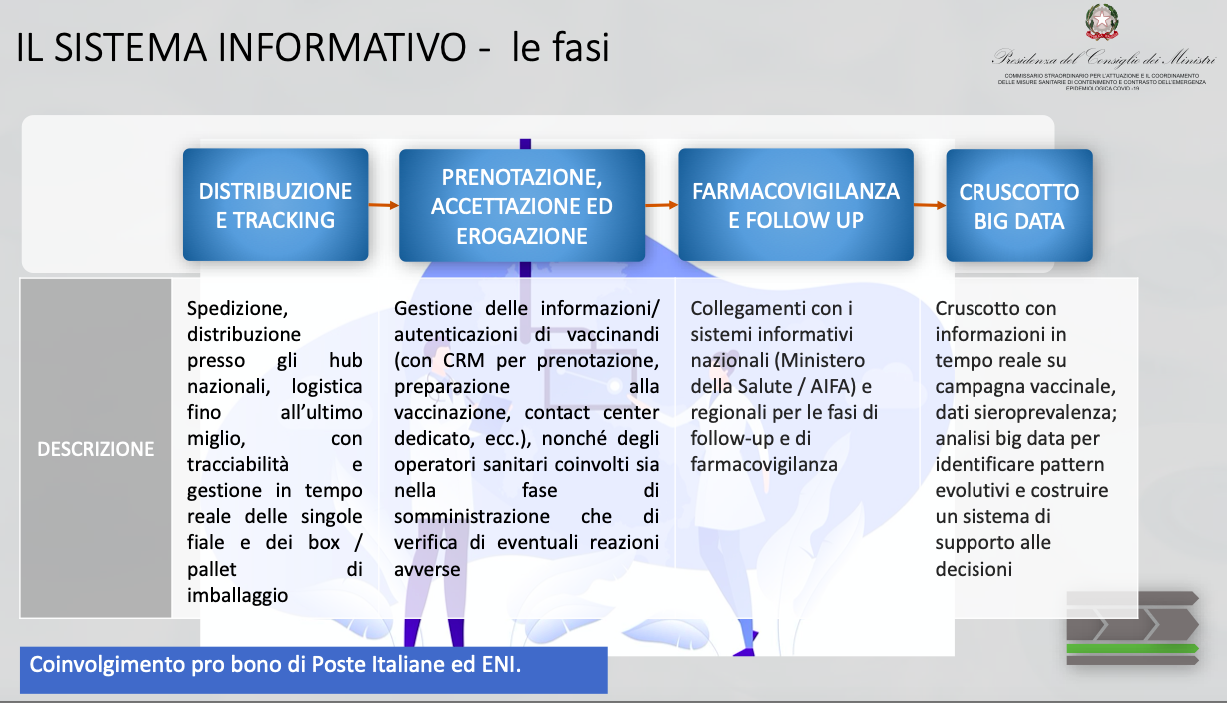
Sorge spontanea una domanda: ciò che non è stato realizzato in alcuni anni è realizzabile in pochi giorni?
Non si vuole mettere in discussione la realizzazione del sistema informativo, ma questo, come altri importanti paradossi e contraddizioni, non fanno che minare irrimediabilmente la fiducia dei cittadini nelle istituzioni politiche e sanitarie.
Per concludere, si si mettono in evidenza ancora almeno due criticità rilevanti sotto il profilo della sicurezza, oggetto di Specific Obligation per il titolare della autorizzazione all’immissione in commercio condizionata (CMA):
- I dati (NdR: forniti) dimostrano la presenza di forme troncate/modificate di mRNA a livelli un po' più elevati nei lotti prodotti con il processo commerciale rispetto al materiale utilizzato negli studi clinici. Queste forme non sono sufficientemente caratterizzate e, sebbene i limitati dati forniti per l'espressione della proteina non affrontino completamente le incertezze relative al rischio di tradurre proteine/peptidi diversi dalla proteina spike prevista, si prevede che la quantità di tali proteine sia troppo bassa per suscitare una risposta immunitaria di rilevanza biologica. Dovrebbero essere forniti i dati di caratterizzazione delle proteine/peptidi rilevanti per le specie predominanti.
- Deve essere valutata qualsiasi omologia tra le proteine tradotte (diverse dalla proteina spike prevista) e le proteine umane che, a causa del mimetismo molecolare, possono potenzialmente causare un processo autoimmune.
Alla luce di tutto quanto emerge dalla nostra analisi, è fondamentale che i cittadini possano compiere una scelta informata, consapevole e responsabile esercitando pienamente il diritto al Consenso Informato.
NOTE:
1 Vedi Comunicazione della Commissione COM(2020) 245 final
https://eur-lex.europa.eu/legal-content/IT/TXT/HTML/?uri=CELEX:52020DC0245&from=EN
2 https://corporateeurope.org/en/2020/09/power-and-profit-during-pandemic
3 https://www.ft.com/content/12f7da5b-92c8-4050-bcea-e726b75eef4d
4 https://www.fda.gov/media/144413/download
5 L’Advisory Committee on Immunization Practices (ACIP) è un comitato interno dei CDC (i Centri statunitensi per il controllo e la prevenzione delle malattie) che sviluppa le raccomandazioni sull'uso dei vaccini nella popolazione civile degli Stati Uniti.
6 https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2020-12/slides-12-19/05-COVID-CLARK.pdf
7 Si tratta uno strumento di sorveglianza attiva sviluppato attraverso una APP per smartphone che utilizza messaggi di testo e sondaggi rivolto a coloro che hanno ricevuto una vaccinazione COVID-19. Attraverso V-safe, l’utente può segnalare al CDC se ha avuto effetti collaterali dopo la somministrazione del vaccino COVID-19. A seconda delle risposte, il CDC potrebbe mettersi in contatto con l’utente per ulteriori verifiche e approfondimenti. L’utente sarà contattato via app una volta alla settimana per un massimo di 5 settimane. L’applicazione ricorderà all’utente l’appuntamento per l’eventuale seconda dose di vaccino COVID-19. Dopo la seconda dose l’utente sarà seguito per 6 settimane (una volta alla settimana) e ricontattato dopo 3, 6 e 12 mesi. (Vedi https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/vsafe.html, https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/faq.html)
8 Le "revisioni a rotazione” consentono a EMA di valutare i dati non appena disponibili, invece di attendere la conclusione di tutte le sperimentazioni. Attraverso le revisioni a rotazione EMA valuta i dati mentre lo sviluppo è ancora in corso e prima che lo sviluppatore del vaccino presenti una richiesta di autorizzazione all'immissione in commercio.
10 https://www.fda.gov/vaccines-blood-biologics/vaccines/emergency-use-authorization-vaccines-explained
11 Vedi https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf, pag. 140
12 https://eur-lex.europa.eu/legal-content/IT/TXT/HTML/?uri=CELEX:52020DC0245&from=EN, https://www.europarl.europa.eu/news/it/press-room/20200706IPR82731/covid-19-il-parlamento-deve-consentire-uno-sviluppo-piu-rapido-dei-vaccini#:~:text=La%20Commissione%20ha%20proposto%20un,o%20sono%20costituiti%20da%20OGM.,
https://data.consilium.europa.eu/doc/document/PE-28-2020-INIT/en/pdf
13 https://www.ema.europa.eu/en/documents/rmp/comirnaty-epar-risk-management-plan_en.pdf
15 https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_it.pdf
16 https://www.aifa.gov.it/-/vaccini-causano-molto-raramente-anafilassi-uno-studio-del-cdc
https://www.sciencedirect.com/science/article/abs/pii/S0091674915011604
17 https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2020-12/slides-12-19/05-COVID-CLARK.pdf
19 I PSUR sono documenti di farmacovigilanza destinati a fornire una valutazione del rapporto rischio/beneficio di un medicinale in un determinato momento dopo l'autorizzazione.
L'obiettivo del PSUR è di presentare un'analisi completa e critica del rapporto rischio/beneficio del prodotto, tenendo conto delle informazioni nuove o emergenti in materia di sicurezza nel contesto delle informazioni cumulative su rischi e benefici. (Vedi https://www.ema.europa.eu/en/human-regulatory/post-authorisation/pharmacovigilance/periodic-safety-update-reports-psurs
20 https://brightoncollaboration.us/wp-content/uploads/2020/10/JVAC-S-20-02520_mzd.pdf
21 https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_it.pdf
22 https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_it.pdf
23 https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_it.pdf
24 http://www.salute.gov.it/imgs/C_17_pubblicazioni_2986_allegato.pdf
25 https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_it.pdf
28 http://www.quotidianosanita.it/allegati/allegato6825441.pdf
















